Общая химия/Субатомные частицы
Свойства частиц
Прежде чем изучать субатомные частицы, следует понять некоторые основные свойства.
Заряд
Частицы могут иметь электрический заряд. Заряд — это свойство, которое определяет силу, которую частица будет оказывать на другие заряженные частицы. Существует хорошо известная поговорка, которая прекрасно применима: "Противоположности притягиваются". (Аналогично, одноименные заряды отталкиваются.) Положительные и отрицательные заряды будут притягиваться друг к другу и объединяться. Два положительных или два отрицательных заряда будут отталкиваться друг от друга.
Шаблон:Полезная подсказка Количество заряда частицы измеряется в кулоны, но его удобнее выражать целым числом. Например, ион гелия, у которого на 2 электрона меньше обычного, имеет заряд +2, а ион брома с одним электроном больше обычного имеет заряд -1. (Это может показаться странным, но помните, что электрон имеет отрицательный заряд.) Обратите внимание, что заряд применим не только к субатомным частицам, но также и к ионам и другим вещам. Всегда помните, что заряд положительный или отрицательный. В отличие от обычных чисел, мы всегда пишем знак плюс для положительных зарядов, чтобы избежать путаницы с отрицательным зарядом.
Масса
Масса — это мера инерции. С субатомной точки зрения массу также можно понимать в терминах энергии, но это не имеет значения, когда мы имеем дело с химией. Масса частиц, атомов и молекул измеряется не в граммах, как у обычных веществ. Вместо этого она измеряется в «атомных единицах массы», или «а.е.м.». Для получения дополнительной информации о массе и а.е.м. прочитайте предыдущие главы о свойствах материи.
Ядро
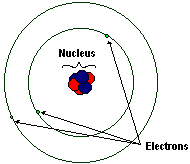
В центре каждого атома находится ядро. Оно невероятно мало: если бы вы взяли средний атом (сам по себе крошечный по размеру) и расширили его до размеров футбольного стадиона, то ядро было бы размером примерно с шарик. Однако он поразительно плотный: несмотря на крошечный процент объема атома, он содержит почти всю массу атома. Ядро почти никогда не меняется при нормальных условиях, оставаясь постоянным на протяжении химических реакций. Ядра сами по себе состоят из пары более мелких и более плотных частиц, протона и нейтрона. Эти частицы совместно называются нуклонами.
Протоны
Протоны имеют заряд +1 и массу 1 а.е.м.. Их часто обозначают как .
Протоны будут важны при изучении кислот и оснований — они являются сущностью кислоты. Помните, что число протонов в атоме является его атомным номером и определяет, каким элементом он будет. Число протонов в ядре варьируется от одного до более чем ста.
Рассмотрим элемент водород. Его атомный номер равен 1, поэтому у него один протон и один электрон. Если его превратить в ион (атом с отсутствующими или лишними электронами), он будет просто одиноким протоном. Таким образом, протон является ядром атома водорода, а протон является ионом водорода. Поэтому протон можно записать как или , оба символа обозначают ион водорода.
Нейтроны
Нейтроны не имеют заряда и имеют массу 1 а.е.м. Нейтрон немного тяжелее протона, но разница незначительна. Нейтроны часто записывают как . Шаблон:SideBox
В отличие от протонов, нейтроны не могут существовать вне ядра бесконечно, поскольку они становятся нестабильными и распадаются. Внутри одного ядра может быть много протонов и нейтронов, все в непосредственной близости друг от друга. Количество нейтронов в ядре варьируется от нуля до более чем сотни.
Вы можете задаться вопросом, почему существуют нейтроны. У них нет заряда, так что они могут что-то делать? Ответ - да, нейтроны очень важны. Помните, что противоположности притягиваются, а подобные отталкиваются. Если так, то как несколько протонов могут оставаться сгруппированными в плотном ядре атома? Казалось бы, протоны будут отталкиваться и рассеивать ядро. Однако существует сильная ядерная сила, которая удерживает ядро вместе. Эта невероятная сила заставляет нуклоны притягиваться друг к другу с гораздо большей силой, чем электрическая сила может их отталкивать, но только на чрезвычайно коротких расстояниях.
Между числом протонов и нейтронов существует тонкий баланс. Протоны, которые притягиваются друг к другу посредством сильной силы, но одновременно отталкиваются своими электромагнитными зарядами, не могут существовать в большом количестве внутри ядра без стабилизирующего действия нейтронов, которые притягиваются посредством сильной силы, но не заряжены. И наоборот, нейтроны придают ядру присущую им нестабильность, и слишком большое их количество дестабилизирует его.
Наконец, нейтроны очень важны в ядерных реакциях, например, тех, которые используются на электростанциях. Нейтроны действуют как пуля, которая может расщепить ядро атома. Поскольку у них нет заряда, нейтроны не притягиваются и не отталкиваются атомами и ионами.
Электронное облако
Плотное ядро окружает облако электронов. Электроны имеют заряд -1 и массу 0 а.е.м. Это не значит, что они безмассовые. Электроны имеют массу, но она настолько мала, что не влияет на общую массу атома. Электрон имеет приблизительно 1/1800 массы протона или нейтрона. Электроны записываются как .
Электроны вращаются по орбите снаружи ядра, не подвергаясь воздействию сильного ядерного взаимодействия. Они определяют химические свойства атома, поскольку практически каждая химическая реакция связана с взаимодействием или обменом внешних электронов атомов и молекул.
Электроны притягиваются к ядру атома, поскольку они отрицательны, а ядро (состоящее из протонов и нейтронов) положительно. Противоположности притягиваются. Однако электроны не падают в ядро. Они вращаются вокруг него на определенных расстояниях, поскольку электроны обладают определенным количеством энергии. Эта энергия не позволяет им приближаться слишком близко, поскольку они должны поддерживать определенную скорость и расстояние. Изменения энергетических уровней электронов вызывают различные явления, такие как спектральные линии, цвет веществ и создание ионов (атомов с отсутствующими или лишними электронами).
Взаимодействие электронов
Атомы всегда будут иметь равное количество протонов и электронов, поэтому их общий заряд равен нулю. Атомы нейтральны. Ионы, с другой стороны, являются атомами, которые приобрели или потеряли электроны и теперь имеют неравное количество протонов и электронов. Если есть лишние электроны, ион будет заряжен отрицательно. Если есть недостающие электроны, ион будет заряжен положительно из-за большинства положительных протонов.
Валентные электроны (внешние электроны) отвечают за поведение атома в химических связях. Основные электроны - это все электроны, не находящиеся на внешней оболочке, и они редко участвуют. Атом будет пытаться заполнить свою валентную оболочку. Это происходит, когда у атома есть восемь валентных электронов (как объясняется в следующей главе), поэтому атомы будут вступать в химические связи, чтобы либо поделиться, либо отдать, либо забрать необходимые ему электроны. Например, натрий, скорее всего, отдаст свой один валентный электрон, так что его внешняя оболочка будет пустой (оболочка под ним будет заполнена). Хлор, скорее всего, заберет электрон, потому что у него их семь, а ему нужно восемь. Когда натрий и хлор смешиваются, они обмениваются электронами и создают хлорид натрия (поваренную соль). В результате оба элемента имеют полные валентные оболочки, и образуется очень стабильное соединение.